Vacina da Pfizer em crianças de 5 a 11 anos atende a critérios, diz FDA
Estudo diz que imunizante foi 90,7% eficaz na prevenção da Covid-19 sintomática na faixa etária
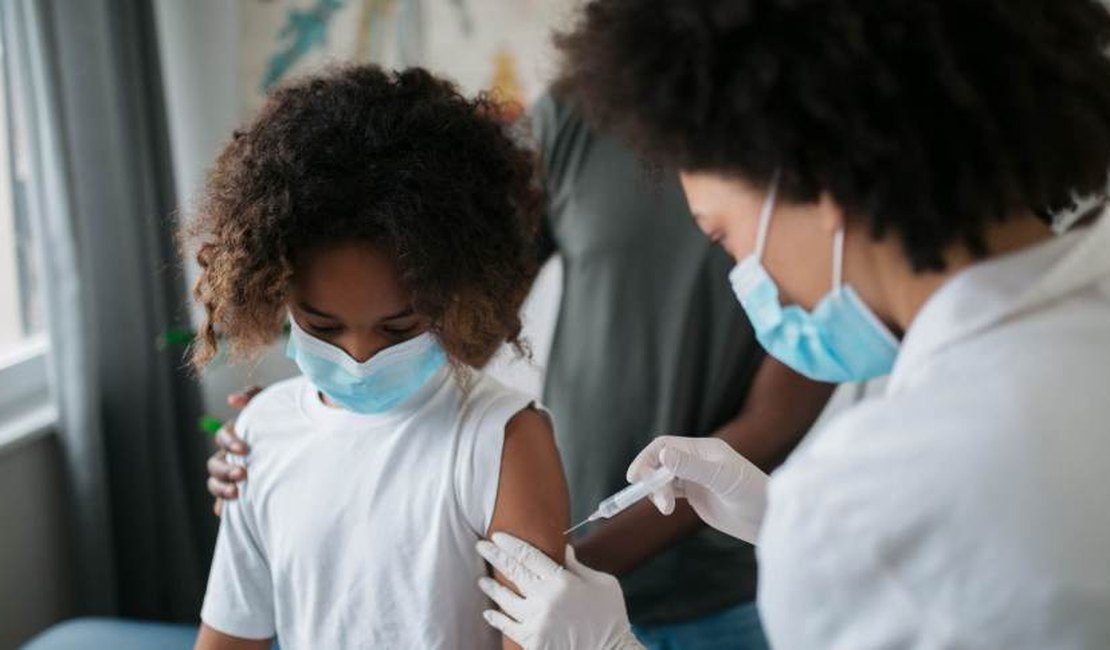
A autoridade sanitária dos Estados Unidos (FDA, na sigla em inglês) disse que a vacina contra a Covid-19 desenvolvida pela Pfizer e BioNTech atendeu aos critérios da agência para respostas imunológicas em um estudo em crianças de 5 a 11 anos.
Em relatório divulgado na sexta-feira (22), a agência sinalizou o risco de doenças cardíacas, incluindo miocardite associada à vacina, mas disse que os benefícios gerais na prevenção contra a Covid-19 e hospitalizações superariam o risco de doenças cardíacas.
A avaliação da FDA pode apoiar a autorização da agência da vacina em crianças nos próximos dias ou semanas, mas o risco de miocardite provavelmente será um tópico de debate entre os conselheiros da agência.
A FDA confirmou os dados que as empresas haviam divulgado no início do dia, mostrando que a vacina foi 90,7% eficaz na prevenção da Covid-19 sintomática em um estudo com crianças de 5 a 11 anos, informação que as autoridades de saúde provavelmente considerarão antes de autorizar o uso.
A vacina foi considerada segura e tolerável, disseram as empresas em um documento enviado à FDA. No início de outubro, a Pfizer e a BioNTech pediram ao órgão que autorizasse a vacina para crianças de 5 a 11 anos.
Os documentos foram publicados antes de uma reunião, agendada para terça-feira (26), do Comitê Consultivo de Vacinas e Produtos Biológicos Relacionados, composto por especialistas, para aconselhar a FDA.
O comitê se reunirá para revisar as evidências da segurança e eficácia do imunizante em crianças e votar para recomendar se o FDA deve autorizar o uso. Se o voto for favorável, a autorização do FDA poderá ser feita em poucos dias.
Últimas notícias

Polícia Civil investiga ataque a tiros que deixou um morto e dois feridos em Carneiros

Homem com mandado por violência doméstica é preso após ser identificado por reconhecimento facial em Maceió

Zé Felipe expõe sofrimento após término com Ana Castela e viraliza

Casados viralizam ao expor como lidam com atração por outras mulheres

Fala de Frei Gilson sobre Carnaval volta a viralizar e divide opiniões

Barrada no trio? Jojo Todynho reage após vídeo no Carnaval de Salvador
Vídeos e noticias mais lidas

Defesa de Vitinho repudia oferta de recompensa e afirma que jovem corre risco de vida

Luciano Barbosa irá assinar ordem de serviço para o início das obras na Avenida Pio XII

Vigia que ‘terceirizou’ próprio posto terá de ressarcir aos cofres públicos R$ 104 mil

Indústria brasileira do setor alimentício terá fábrica em Rio Largo

